目前临床上治疗AD,主要是采用药物对症处理控制伴发的精神病理症状,包括抗焦虑药、抗抑郁药以及抗精神病药,但疗效一般短暂;另一种是作用于神经递质类药物或脑代谢赋活药物,主要用于改善认知。AD目前尚无特效治疗药物,现有药物疗效不明显。本文主要分析AD的研究现状,展望间充质干细胞(mesenchymal stem cells,MSCS)的治疗前景。
国际制药巨头公司一直在聚焦AD的新药研发,但是进展并不顺利。2016年11月23日,礼来制药公司(Lilly)进行了一项长达27年的研究,投入了近30亿美元,研发抗AD新药Solanezzumab,在Ⅲ期试验中宣告失败。2017年2月14日,默沙东制药公司研发治疗AD的新药Verubecestat,也被告知"几乎不可能得到一个积极的临床结果"而终止其临床试验,这给万众瞩目的AD新药研发泼了一盆冷水。
有Meta文献分析,1990~2018年中国AD患病率为3.4%,预测到2050年60岁以上的老年人患病人数将是2010年的2.52倍,老年人口在2010~2050年大幅增加,2050年预计我国AD的直接经济负担将达每年7453.21亿元。伴随未来老年人口的增加,AD患病人数逐年上升,需探寻对AD有效的治疗药物或新方法。
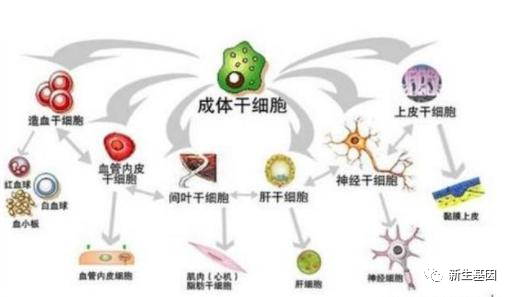
在探寻新药治疗AD屡屡受挫的情况下,科学家们把目标转向神经干细胞(neural stem cells,NSCs)治疗AD的新尝试。NSCs的来源包括胚胎干细胞、诱导性多能干细胞和成体MSCs等。由于胚胎干细胞和诱导性多能干细胞存在致瘤性风险,多数研究者将目标聚焦到成体间充质细胞来源的干细胞。然而MSCs属于中胚层,神经组织属于外胚层,要将成熟的中胚层细胞转分化外胚层神经细胞,这种跨胚层转分化的技术难度很大。
近期研究显示,MSCs不仅能分化为中胚层系的细胞,还能分化为内胚层和外胚层细胞,包括神经元和胶质细胞。因此,MSCs被广泛研究,以发展基于细胞的治疗策略,特别是对于那些药物治疗效果不佳的疾病。
在动物实验的基础上,国内外学者也开展了干细胞治疗AD的相关临床试验。
韩国生物技术公司Nature Cell将自体脂肪干细胞用于AD的Ⅰ/Ⅱ期临床研究试验已于2016年11月24日获得美国食品药品监督管理局的批准。在该研究的前期动物实验中发现,选用脂肪干细胞是因为自体人类脂肪来源干细胞不会引起免疫排斥反应、肿瘤发生或伦理问题,且显示静脉移植的人类脂肪来源干细胞可以通过血脑屏障迁移到大脑。
静脉注射人类脂肪来源干细胞至少4个月后,AD小鼠模型的学习、记忆和病理均有明显改善,注射人类脂肪来源干细胞的Tg小鼠与注射Tg-sham的小鼠相比,其大脑中淀粉样斑块的数量和5-羟色胺水平显著下降。这一研究首次报道了通过静脉或脑内移植的人类脂肪来源干细胞,通过上调白细胞介素(interleukin,IL)-10和血管内皮生长因子(vascular endothelial growth factor,VEGF),在Tg小鼠大脑中显著挽救了记忆缺陷和神经病理学改变,并可能用于AD的预防和治疗。
异体MSCs治疗老年AD的临床应用也有报道。此前,美国Longeveron生物制药公司,宣布自2016年10月至2020年9月招募33例50~80岁的AD患者参与Ⅰ期临床试验,以评估其骨髓异体MSCs产品对老年AD患者治疗的安全性和有效性,这项随机、安慰剂对照和双盲的临床试验,将在佛罗里达州迈阿密大学米勒医学院、迈阿密犹太卫生系统和大脑研究所进行。
国内研究机构选择的脐带MSCs来源于脐带组织,受病源污染的风险小,细胞活力有保障,且干细胞含量非常丰富,增殖能力强,旁分泌细胞因子能力显著强于骨髓MSCs。研究表明MSCs移植的治疗效果与其同宿主细胞之间动态的、交互的旁分泌作用有关。
MSCs是一类可自我更新和具有多向分化潜能的细胞,已应用于包括AD、帕金森病、脑卒中偏瘫等多种疾病的治疗,动物实验及初步临床试验结果显示效果良好。在干细胞移植技术及方法学方面,包括静脉注射、腰大池注射及脑组织内多靶点定位移植等技术方法。
综上所述,AD采用干细胞移植方式治疗,主要有以下3种方式:
(1)通过旁分泌免疫调节因子抑制炎症反应,降低炎性因子的释放,减小β-淀粉样蛋白;
(2)通过分泌神经营养因子,营养和保护胆碱能神经元,并促进内源性神经元再生;
(3)一部分移植的细胞存活并分化为神经元,替代受损的神经细胞,重建认知环路。专家们预测,干细胞疗法在5~10年内有望成为治疗AD的有效方法,造福广大的AD患者,具有重大的社会和经济效益。